recherche sur le vieillissement : Les 12 causes du vieillissement

Table des matières
Le vieillissement de l’organisme est constitué d’une série de processus interdépendants. Les recherches biomédicales les plus récentes ont donné naissance aux »caractéristiques du vieillissement », ces processus qui, au niveau cellulaire, contrôlent le processus de vieillissement.
1. changements épigénétiques
Notre génome est constitué de longs brins d’ADN enroulés autour de bobines de protéines (histones). Ces histones sont dotées de dispositifs chimiques qui favorisent l’activation et la désactivation des gènes. Ces dispositifs de commutation constituent ce que l’on appelle l’épigénome. L’épigénome évolue avec l’âge, ce qui peut affecter la coordination harmonieuse de l’activité des gènes. Les sirtuines constituent un groupe d’enzymes particulièrement bien étudié qui influence l’épigénome. Mais l’alimentation, les médicaments ou la modification du mode de vie peuvent également modifier l’épigénome.
2. perte de la protéostasie
La principale fonction des gènes est de fabriquer des protéines. Celles-ci régulent pratiquement toutes les réactions chimiques de la cellule et doivent être pliées dans des formes précises pour remplir leur fonction. Avec l’âge, des repliements incorrects apparaissent suite à des dommages épigénétiques, ce qui empêche les protéines de remplir leur fonction. Le processus qui régule le maintien de toutes les protéines dans leur forme initiale s’appelle la protéostasie.
3. autophagie désactivée
L’autophagie est un processus dans nos cellules qui décompose les composants cellulaires endommagés ou non fonctionnels et réutilise leurs composants. C’est en quelque sorte un mécanisme de recyclage. Cette fonction est essentielle au maintien de la santé cellulaire et à la protection contre les accumulations toxiques. Avec l’âge, l’autophagie diminue, ce qui signifie que les »déchets » cellulaires, tels que les protéines ou les organelles endommagées, ne sont plus entièrement éliminés. Cela favorise le développement de maladies liées à l’âge, telles que les maladies neurodégénératives ou le cancer.
4. mesure déréglée des nutriments
Lorsque les nutriments sont abondants dans le corps, les cellules se multiplient. En revanche, lorsqu’ils sont rares, l’organisme se concentre sur l’entretien et la réparation. Des études ont été menées pour faire croire au corps qu’il manque de nutriments en réduisant la nourriture et/ou en prenant des médicaments. Ces stratégies ont permis d’améliorer la santé et la longévité chez les animaux.
5. dysfonctionnement des mitochondries
Les mitochondries sont les »centrales électriques de la cellule », mais elles produisent également des radicaux libres (espèces réactives de l’oxygène ou ROS) qui endommagent les cellules. Une nouvelle piste de réflexion suggère que les radicaux libres d’oxygène pourraient être importants pour signaler le stress cellulaire, ce qui permettrait aux cellules, aux organes et aux tissus d’augmenter leurs processus de maintenance et de réparation.
6. sénescence cellulaire
La sénescence cellulaire est un phénomène par lequel les cellules cessent de se diviser. Avec l’âge, ces cellules vieillissantes s’accumulent et émettent des signaux nocifs dans l’environnement. La cause de la sénescence cellulaire est un raccourcissement des télomères, des parties de l’ADN dans les chromosomes qui sont importantes pour tous les processus biologiques. Ils sont associés au vieillissement.
Des travaux récents, dans lesquels des souris ont été génétiquement modifiées pour permettre aux chercheurs d’éliminer un grand nombre de leurs cellules sénescentes, ont montré des preuves d’avantages pour la santé, notamment une durée de vie plus longue. Des travaux sont actuellement en cours pour identifier des médicaments qui ciblent l’élimination des cellules sénescentes.
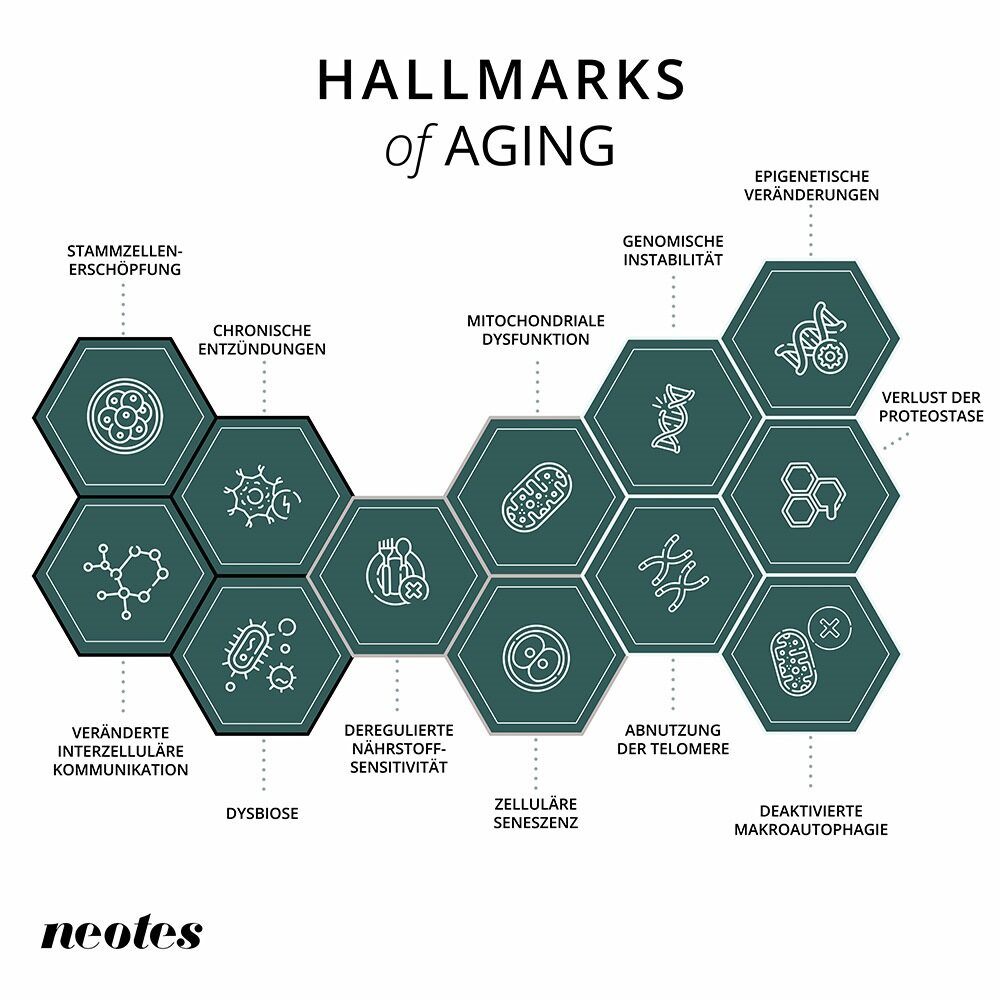
7. épuisement des cellules souches
La capacité de notre corps à régénérer des tissus et des organes dépend de cellules souches saines. Elles peuvent se différencier en différents types de cellules, puis se répliquer si nécessaire. Avec l’âge, les pools de cellules souches se vident ou les cellules souches vieillissantes ne fonctionnent plus aussi bien.
8. modification de la communication intracellulaire
La communication entre les cellules et les tissus est essentielle pour le maintien des fonctions corporelles. Les hormones, par exemple, sont des messagers importants pour la communication cellulaire. L’inflammation chronique liée à l’âge, probablement due à la sénescence des cellules, peut réduire considérablement ou perturber la communication. Le rétablissement d’une communication intracellulaire correcte pourrait améliorer la santé, par exemple en réduisant l’inflammation chronique liée à l’âge.
9. inflammation chronique
L’inflammation chronique est une autre caractéristique du vieillissement, qui se caractérise par des réactions inflammatoires persistantes dans tout le corps. Contrairement à l’inflammation aiguë, qui assure une défense rapide et efficace contre des menaces telles que les infections, l’inflammation chronique reste active sur une longue période. Elle est souvent déclenchée par des facteurs liés à l’âge, tels que des cellules sénescentes, un ADN endommagé ou des mitochondries dysfonctionnelles. Ces processus inflammatoires peuvent entraîner une détérioration des fonctions cellulaires et tissulaires et augmenter le risque de maladies liées à l’âge telles que la maladie d’Alzheimer, le diabète et les maladies cardiovasculaires.
10. dysbiose du microbiome
Le microbiome, en particulier, qui se trouve dans l’intestin humain, joue un rôle important dans notre santé et dans le processus de vieillissement. Plus nous vieillissons, plus la composition de la flore intestinale se modifie. Ce processus est appelé dysbiose. Cette altération peut affaiblir le système immunitaire, favoriser les inflammations chroniques et nuire à l’absorption des nutriments. La dysbiose est également associée à des maladies liées à l’âge telles que le diabète, les maladies cardiaques et les troubles neurodégénératifs.
11. instabilité génomique
Le génome, ou le patrimoine génétique d’un être vivant, est responsable du bon fonctionnement de toutes les fonctions du corps. Des polluants externes ou internes, tels que la pollution ou les radicaux libres, endommagent en permanence l’ADN de nos cellules ; les processus de réparation cellulaires peuvent détecter ces dommages et les réparer. Avec l’âge, les dommages au génome s’accumulent et les processus de réparation ne peuvent plus suivre. Le cancer est une conséquence des dommages non réparés de l’ADN. Les êtres vivants dont les processus de réparation de l’ADN sont altérés présentent des signes de vieillissement accéléré.
12. raccourcissement des télomères
L’usure des télomères est un type particulier d’instabilité génomique. Les télomères sont des séquences d’ADN répétitives qui protègent les extrémités des chromosomes et les empêchent d’être confondues avec des brins d’ADN cassés. Les télomères déterminent notre âge et sont raccourcis par la division cellulaire normale, mais aussi par des processus qui endommagent l’ADN. Lorsque les télomères atteignent une longueur critiquement courte, la réplication de la cellule est désactivée. La télomérase, une enzyme du noyau cellulaire, peut empêcher le raccourcissement des télomères et même restaurer la longueur des télomères.
Sources :
- Carlos López-Otín, Maria A Blasco, Linda Partridge, Manuel Serrano. Les marques du vieillissement. Cell. 2013 Jun 6;153(6):1194-1217. doi : 10.1016/j.cell.2013.05.039 .
- https://www.pexels.com/de-de/foto/sonnig-fashion-mode-strand-5263471



