Vücudun yaşlanması birbirine bağlı bir dizi süreçten oluşur. Son biyomedikal araştırmalar, yaşlanma sürecini hücresel düzeyde kontrol eden süreçler olan ”yaşlanmanın ayırt edici özelliklerinin” geliştirilmesine yol açmıştır.
1. epigenetik değişiklikler
Genomumuz, protein sarmallarının (histonlar) etrafına sarılmış uzun DNA ipliklerinden oluşur. Bu histonlar, genlerin açılıp kapanmasını destekleyen kimyasal aygıtlarla donatılmıştır. Bu anahtarlama cihazları epigenom olarak adlandırılan yapıyı oluşturur. Epigenom yaşla birlikte değişir ve bu da gen aktivitesinin düzgün koordinasyonunu bozabilir. Sirtuinler, epigenomu etkileyen özellikle iyi çalışılmış bir enzim grubudur. Bununla birlikte, diyet, ilaçlar veya yaşam tarzı değişiklikleri de epigenomu değiştirebilir.
2. Proteostaz kaybı
Genlerin ana görevi protein üretmektir. Bunlar hücredeki hemen hemen tüm kimyasal reaksiyonları düzenler ve görevlerini yerine getirmek için hassas şekillerde katlanmaları gerekir. Yaşlılıkta, epigenetik hasar nedeniyle yanlış katlanma meydana gelir ve bunun sonucunda proteinler artık görevlerini yerine getiremez. Tüm proteinlerin orijinal formlarında korunmasını düzenleyen sürece proteostaz denir.
3. devre dışı bırakılmış otofaji
Otofaji, hücrelerimizde hasarlı veya çalışmayan hücre bileşenlerini parçalayan ve bileşenlerini yeniden kullanan bir süreçtir. Tabiri caizse bir geri dönüşüm mekanizmasıdır. Bu işlev, hücresel sağlığı korumak ve toksik birikime karşı korunmak için gereklidir. Otofaji yaşla birlikte azalır, bu da hasarlı proteinler veya organeller gibi hücresel ”atıkların” artık tamamen ortadan kaldırılamadığı anlamına gelir. Bu da nörodejeneratif hastalıklar veya kanser gibi yaşa bağlı hastalıkların gelişimini teşvik eder.
4. düzensiz besin ölçümü
Eğer vücutta bol miktarda besin varsa, hücreler çoğalır. Ancak bunlar azsa, organizma bakım ve onarım üzerine yoğunlaşır. Besin azaltma ve/veya ilaç tedavisi yardımıyla vücuttaki besin eksikliklerini simüle etmek için çalışmalar geliştirilmiştir. Bu stratejiler hayvan deneylerinde sağlığı ve uzun ömrü iyileştirmiştir.
5. Mitokondri işlev bozukluğu
Mitokondriler ”hücrenin enerji santralleridir”, ancak aynı zamanda hücrelere zarar veren serbest radikalleri (reaktif oksijen türleri veya ROS) de üretirler. Yeni bir düşünce çizgisi, oksijen radikallerinin hücresel strese işaret etmede önemli olabileceğini ve hücrelerin, organların ve dokuların bakım ve onarım süreçlerini artırmalarına neden olabileceğini öne sürüyor.
6. hücresel yaşlanma
Hücresel yaşlanma, hücrelerin bölünmeyi durdurduğu bir olgudur. Yaş ilerledikçe, bu yaşlanan hücreler birikir ve çevreye zararlı sinyaller yayar. Hücresel yaşlanmanın nedeni, tüm biyolojik süreçler için önemli olan kromozomlardaki DNA bileşenleri olan telomerlerin kısalmasıdır. Bunlar yaşlanma ile ilişkilidir.
Araştırmacıların yaşlanan hücrelerinin çoğunu ortadan kaldırabilmeleri için farelerin genetik olarak tasarlandığı son çalışmalar, daha uzun bir yaşam süresi de dahil olmak üzere sağlık yararlarına dair kanıtlar göstermiştir. Yaşlanan hücrelerin ortadan kaldırılmasını hedefleyen ilaçların belirlenmesi için çalışmalar halen devam etmektedir.
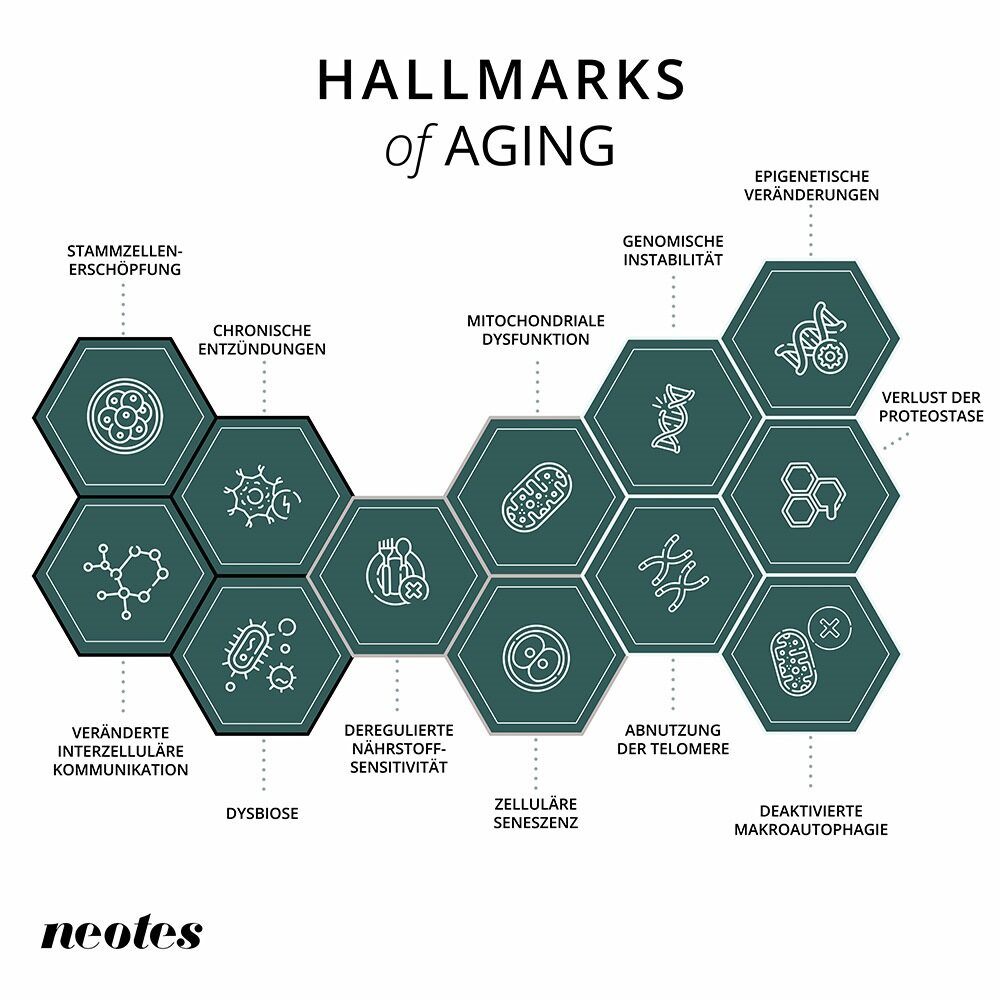
7. Kök hücrelerin tükenmesi
Vücudumuzun doku ve organları yenileme yeteneği sağlıklı kök hücrelere bağlıdır. Farklı hücre tiplerine farklılaşabilir ve daha sonra gerektiği gibi çoğalabilirler. Yaş ilerledikçe kök hücre havuzları tükenir ya da yaşlanan kök hücreler artık işlevlerini yerine getiremez hale gelir.
8. değişmiş hücre içi iletişim
Hücreler ve dokular arasındaki iletişim, bedensel işlevlerin sürdürülmesi için gereklidir. Örneğin hormonlar, hücre iletişimi için önemli habercilerdir. Muhtemelen yaşlanan hücrelerin bir sonucu olan yaşa bağlı kronik enflamasyon, iletişimi önemli ölçüde azaltabilir veya bozabilir. Uygun hücre içi iletişimin yeniden sağlanması, örneğin yaşa bağlı kronik enflamasyonu azaltarak sağlığı iyileştirebilir.
9 Kronik enflamasyon
Kronik enflamasyon, yaşlanmanın bir başka özelliği olup vücutta kalıcı enflamatuar reaksiyonlarla karakterize edilir. Enfeksiyon gibi tehditlere karşı hızlı ve etkili bir savunma sağlayan akut enflamasyonun aksine, kronik enflamasyon uzun bir süre boyunca aktif kalır. Genellikle yaşlanan hücreler, hasarlı DNA veya işlevsiz mitokondri gibi yaşa bağlı faktörler tarafından tetiklenir. Bu enflamatuar süreçler hücre ve doku fonksiyonlarında bozulmaya yol açabilir ve Alzheimer, diyabet ve kardiyovasküler hastalık gibi yaşa bağlı hastalık riskini artırabilir.
10. mikrobiyomun disbiyozu
İnsan bağırsağında bulunan mikrobiyom, sağlığımızda ve yaşlanma sürecinde özellikle önemli bir rol oynar. Yaşlandıkça, bağırsak floramızın bileşimi daha fazla değişir. Bu süreç disbiyoz olarak bilinir. Bu değişim bağışıklık sistemini zayıflatabilir, kronik enflamasyonu destekleyebilir ve besinlerin emilimini bozabilir. Dysbiosis ayrıca diyabet, kalp hastalığı ve nörodejeneratif bozukluklar gibi yaşa bağlı hastalıklarla da ilişkilidir.
11. genomik kararsızlık
Genom ya da canlı bir organizmanın genetik materyali, tüm vücut fonksiyonlarının sorunsuz çalışmasından sorumludur. Kirlilik veya serbest radikaller gibi dış veya iç kirleticiler, hücrelerimizdeki DNA’ya sürekli zarar verir; hücresel onarım süreçleri bu hasarı tanıyabilir ve telafi edebilir. Yaş ilerledikçe genomdaki hasar birikir ve onarım süreçleri artık buna ayak uyduramaz. Kanser, onarılmamış DNA hasarının bir sonucudur. DNA onarım süreçleri bozulmuş canlı organizmalar hızlandırılmış yaşlanma belirtileri gösterir.
12. telomer kısalması
Telomer yıpranması, genomik istikrarsızlığın özel bir türüdür. Telomerler, kromozomların uçlarını koruyan ve kırık DNA iplikleriyle karıştırılmalarını önleyen tekrarlayan DNA dizileridir. Telomerler yaşam süremizi belirler ve normal hücre bölünmesinin yanı sıra DNA’ya zarar veren süreçlerle de kısalır. Telomerler kritik derecede kısa bir uzunluğa ulaştığında, hücre replikasyonu kapatılır. Hücre çekirdeğinin bir enzimi olan telomeraz, telomerlerin kısalmasını önleyebilir ve hatta telomer uzunluğunu geri kazandırabilir.
Kaynaklar:
- Carlos López-Otín, Maria A Blasco, Linda Partridge, Manuel Serrano. Yaşlanmanın İşaretleri. Cell. 2013 Jun 6;153(6):1194-1217. doi: 10.1016/j.cell.2013.05.039 .
- https://www.pexels.com/de-de/foto/sonnig-fashion-mode-strand-5263471




