Das Altern des Körpers besteht aus einer Reihe miteinander verbundener Prozesse. Aus der jüngsten biomedizinischen Forschung sind die „Kennzeichen des Alterns“ entstanden, jene Vorgänge, die auf zellulärer Ebene den Alterungsprozess steuern.
1. Epigenetische Veränderungen
Unser Genom besteht aus langen DNA-Strängen, die um Proteinspulen (Histone) gewickelt sind. Diese Histone sind mit chemischen Vorrichtungen ausgestattet, die das Ein- und Ausschalten von Genen unterstützen. Diese Schalteinrichtungen bilden das sog. Epigenom. Das Epigenom verändert sich im zunehmenden Alter, wodurch die reibungslose Koordination der Genaktivität beeinträchtigt werden kann. Eine besonders gut untersuchte Gruppe von Enzymen, die das Epigenom beeinflussen, sind die Sirtuine. Aber auch Ernährung, Arzneimittel oder Modifikation des Lebensstils können das Epigenom verändern.
2. Verlust der Proteostase
Die Hauptaufgabe der Gene ist es, Proteine herzustellen. Diese regulieren praktisch alle chemischen Reaktionen der Zelle und müssen, um ihre Aufgabe zu erfüllen, in präzise Formen gefaltet sein. Im Alter treten Fehlfaltungen durch epigenetische Schädigung auf, wodurch die Proteine ihre Aufgabe nicht mehr erfüllen. Der Vorgang, der die Aufrechterhaltung aller Proteine in ihrer ursprünglichen Form reguliert, heißt Proteostase.
3. Deaktivierte Autophagie
Autophagie ist ein Prozess in unseren Zellen, der beschädigte oder nicht funktionierende Zellbestandteile abbaut und deren Bestandteile wiederverwendet. Quasi ein Recyclingmechanismus. Diese Funktion ist essenziell für die Erhaltung der zellulären Gesundheit und den Schutz vor toxischen Ansammlungen. Im Alter nimmt die Autophagie ab, wodurch zellulärer „Müll“ wie geschädigte Proteine oder Organellen nicht mehr gänzlich beseitigt wird. Das fördert die Entstehung altersbedingter Krankheiten wie neurodegenerative Erkrankungen oder Krebs.
4. Deregulierte Nährstoffmessung
Sind im Körper Nährstoffe reichlich vorhanden, vermehren sich die Zellen. Sind diese aber knapp, konzentriert sich der Organismus auf Wartung und Reparatur. Studien wurden entwickelt, um dem Körper mit Hilfe von Nahrungsreduktion und/ oder Medikamenten, Nährstoffmangel vorzutäuschen. Diese Strategien haben Gesundheit und Langlebigkeit im Tierversuch verbessert.
5. Dysfunktion der Mitochondrien
Mitochondrien sind die „Kraftwerke der Zelle“, produzieren aber auch freie Radikale (reaktive Sauerstoffspezies oder ROS), die Zellen beschädigen. Ein neuer Denkansatz besagt, dass die Sauerstoffradikale wichtig sein könnten, zellulären Stress zu signalisieren, wodurch Zellen, Organe und Gewebe ihre Wartungs- und Reparaturprozesse erhöhen.
6. Zelluläre Seneszenz
Zelluläre Seneszenz ist ein Phänomen, bei dem Zellen aufhören, sich zu teilen. Mit zunehmendem Alter akkumulieren diese alternden Zellen, die schädliche Signale in die Umgebung ausscheiden. Die Ursache der zellulären Seneszenz ist eine Verkürzung der Telomere, DNA-Anteile in den Chromosomen, die wichtig für alle biologischen Vorgänge sind. Sie werden mit dem Altern in Zusammenhang gebracht.
Jüngste Arbeiten, bei denen Mäuse gentechnisch so verändert wurden, dass Forscher viele ihrer seneszenten Zellen eliminieren konnten, haben Hinweise auf gesundheitliche Vorteile gezeigt, einschließlich einer längeren Lebensdauer. Derzeit wird daran gearbeitet, Medikamente zu identifizieren, die auf die Elimination der seneszenten Zellen abzielen.
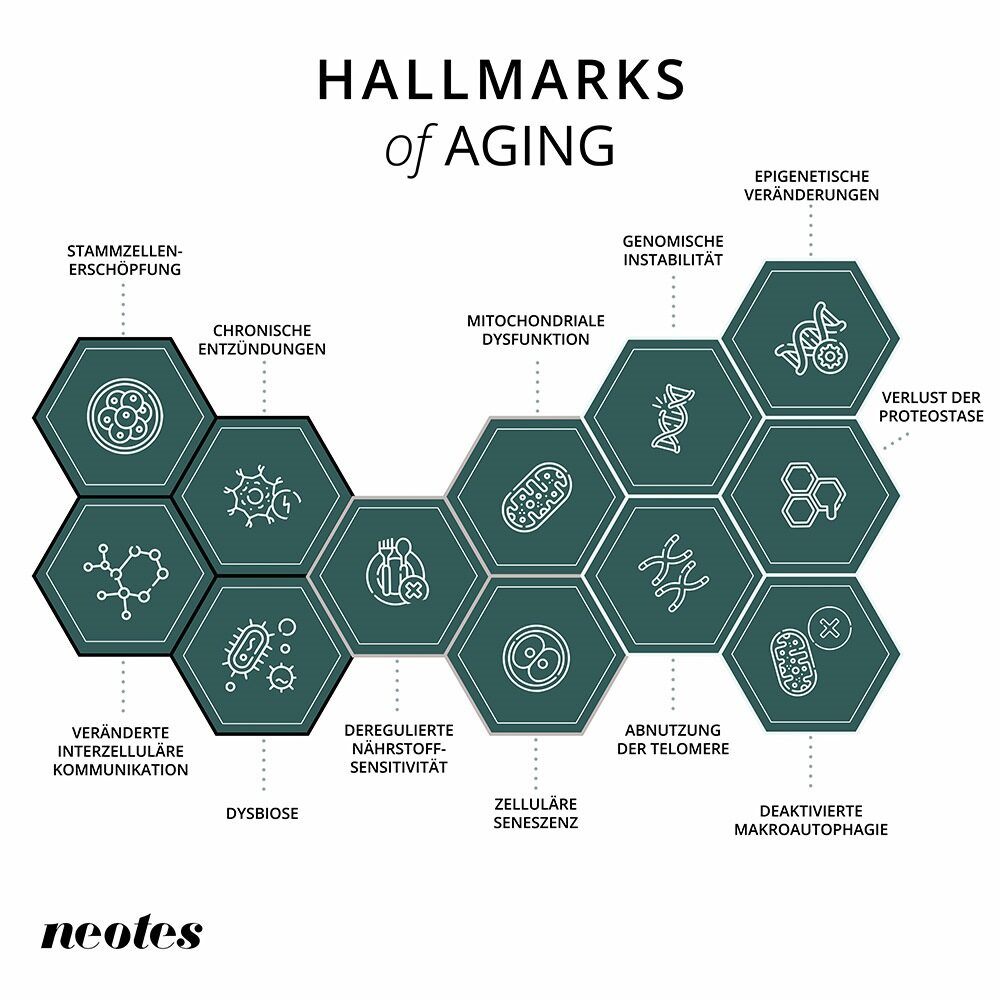
7. Erschöpfung der Stammzellen
Die Fähigkeit unseres Körpers Gewebe und Organe zu regenerieren, hängt von gesunden Stammzellen ab. Sie können sich in verschiedene Zelltypen differenzieren und dann bei Bedarf replizieren. Mit zunehmendem Alter sind die Stammzellpools entleert bzw. die alternden Stammzellen funktionieren nicht mehr so gut.
8. Veränderte Intrazelluläre Kommunikation
Die Kommunikation zwischen Zellen und Gewebe ist essenziell für den Erhalt der Körperfunktionen. Hormone sind z.B. wichtige Botenstoffe zur Zellkommunikation. Altersbedingte chronische Entzündungen, vermutlich als Folge der seneszenten Zellen, können die Kommunikation deutlich verringern oder stören. Die Wiederherstellung einer ordnungsgemäßen intrazellulären Kommunikation könnte die Gesundheit verbessern, z.B. indem chronische altersbedingte Entzündungen reduziert werden.
9. Chronische Entzündung
Chronische Entzündungen sind ein weiteres Merkmal des Alterns, das durch anhaltende Entzündungsreaktionen im gesamten Körper charakterisiert wird. Im Gegensatz zur akuten Entzündung, die eine schnelle und effektive Abwehr gegen Bedrohungen wie Infektionen gewährleistet, bleibt die chronische Entzündung über einen langen Zeitraum aktiv. Sie wird häufig durch altersbedingte Faktoren wie seneszente Zellen, schadhafte DNA oder dysfunktionale Mitochondrien ausgelöst. Diese Entzündungsprozesse können zu einer Verschlechterung der Zell- und Gewebefunktionen führen und das Risiko für altersbedingte Erkrankungen wie Alzheimer, Diabetes und Herz-Kreislauf-Erkrankungen erhöhen.
10. Dysbiose des Mikrobioms
Besonders das Mikrobiom, das sich im menschlichen Darm befindet, spielt eine wichtige Rolle für unsere Gesundheit und den Alterungsprozess. Je älter wir werden, desto mehr verändert sich die Zusammensetzung der Darmflora. Dieser Prozess wird als Dysbiose bezeichnet. Die Veränderung kann das Immunsystem schwächen, chronische Entzündungen begünstigen und die Nährstoffaufnahme beeinträchtigen. Die Dysbiose wird auch mit altersbedingten Krankheiten wie Diabetes, Herzkrankheiten und neurodegenerativen Störungen in Verbindung gebracht.
11. Genomische Instabilität
Das Genom, oder auch das Erbgut eines Lebewesens, ist für den reibungslosen Ablauf aller Körperfunktionen verantwortlich. Externe oder interne Schadstoffe, wie z.B. Verschmutzung oder freie Radikale, beschädigen die DNA in unseren Zellen laufend; zelluläre Reparaturprozesse können diese Schäden erkennen und ausgleichen. Mit zunehmendem Alter häufen sich die Schäden am Genom, die Reparaturprozesse können nicht mehr Schritt halten. Krebs ist eine Folge von nicht reparierten DNA-Schäden. Lebewesen mit beeinträchtigten DNA-Reparaturprozessen zeigen Anzeichen eines beschleunigten Alterns.
12. Telomerverkürzung
Die Abnutzung der Telomere ist eine besondere Art der genomischen Instabilität. Telomere sind sich wiederholende DNA-Sequenzen, welche die Enden der Chromosomen schützen und verhindern, dass sie mit gebrochenen DNA-Strängen verwechselt werden. Telomere bestimmen unser Lebensalter und werden durch die normale Zellteilung verkürzt, aber auch durch Prozesse, die die DNA schädigen. Wenn die Telomere eine kritisch kurze Länge erreichen, wird die Replikation der Zelle ausgeschalten. Telomerase, ein Enzym des Zellkerns, kann die Verkürzung der Telomere verhindern und die Telomerlänge sogar wieder herstellen.
Quellen:
- Carlos López-Otín, Maria A Blasco, Linda Partridge, Manuel Serrano. The Hallmarks of Aging. Cell. 2013 Jun 6;153(6):1194–1217. doi: 10.1016/j.cell.2013.05.039. ↗
- https://www.pexels.com/de-de/foto/sonnig-fashion-mode-strand-5263471

Inhaltsverzeichnis